Umsetzung aromatischer Nitrilverbindungen in die korrespondierenden Carbonsäuren mittels pflanzlicher Nitrilasen (E.C. 3.5.5.1)
Nitrilasen sind Enzyme (Nitrilaminohydrolasen), welche Nitrilverbindungen nach dem Reaktionsschema:
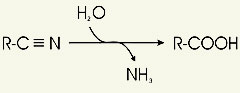
in ihre korrespondierenden Carbonsäuren umsetzen.
Durch Ihre einstufige Umsetzung unterscheiden sich
Nitrilasen von den aus Bakterien bekannten Nitrilhydratasen
und Amidasen, welche über eine zweistufige Reaktion Nitrile über Amide zu Carbonsäuren umsetzen (1) und biotechnologisch ausgiebig genutzt werden.
Die molekulare und funktionelle Charakterisierung von bakteriellen Nitrilasen erfolgte erstmals 1988 durch Stalker et al. (2), die der erste pflanzliche Nitrilase 1992 durch Bartling et al. (3).
Hinsichtlich ihrer Substratspezifität unterscheiden sich pflanzliche Nitrilasen von den bakteriellen Nitrilasen.
Neben den allgemeinen Vorteilen, welche enzymatische Umsetzungen komplexer Substrate (stereo- und regiospezifische Reaktionen) bieten, erscheinen pflanzliche Nitrilasen in Bezug auf ihre biotechnolgische Anwendbarkeit besonders geeignet:
- einfacher Reaktionsmechanismus (ohne Cosubstrate)
- relativ anspruchslose Reaktionsbedingungen
- lange in-vitro Stabilität (>48 Std.),
- Umsetzungen im %-Bereich (getestet mit Indol-3-acetonitril)
- offensichtlich keine Produkthemmung
- viele Subtypen pflanzlicher Nitrilasen in Kulturpflanzen verfügbar.
| Status: |
Zwei klonierte pflanzliche Nitrilasen stehen z. Zeit als bakt. Expressionsklone zur Verfügung; die exprimierte Enzymfunktion kann binnen 3-4 Wochen für Umsetzungsversuche (gegen Kostenerstattung für Expression und Kalibrierung der Enzymaktivität gegenüber Indol-3-acetonitril) zur Verfügung gestellt werden.
|
Projekt: |
Bereitstellung von Subtypen der Nitrilase für Anwenderspezifische-Substratumsetzung über hetrologe reverse Gentechnologie: Option für gewünschte Kooperationspartner/ Auftraggeber: Molekulare Isolierung und funktionelle Identifizierung entsprechender Nitrilase-Subtypen mit Anwender- gewünschten Enzymeigenschaften (ggf. Patentierung durch Partner; Option zur molekularen Enzymmodifikation bzw. Entwicklung eines Enzyms der 2. Generation)
|
Literatur: |
(1) M. Kobayashi et al.(1989): Nitrilase of Rhodococcus rhodochrous J1.
Eur. J. Biochem. 182, pp. 349-356.
(2) D.M. Stalker et al. (1988): Purification and Properties of a Nitrilase Specific for the Herbicide Bromoxynil and Corresponding Nucleotide Sequence Analysis of the bxn gene. J. Biol. Chem. 263, pp. 6310-6314.
(3) D. BARTLING et al. (1992): Cloning and expression of an Arabidopsis nitrilase which can convert indole-3-acetonitrile to the plant hormon indole-3-acetic acid.
Eur. J. Biochem. 205, pp. 417-425.
D. BARTLING et al. (1994): Molecular characterization of two cloned nitrilases from Arabidopsis thaliana - key enzymes in the biosynthesis of the plant hormone indole-3-acetic acid. Proc. Natl. Acad. Sci. USA 91, pp. 6021-6025.
|
zurück zum Start
Molekularbiologisches & biochemisches Labor Dr. Bartling GmbH | Beckendorfstr. 1 | D-33739 Bielefeld-Jö.
Telefon +49 (0) 52 06 / 70 63 95 | Fax +49 (0) 52 06 / 70 68 75 | eMail
|